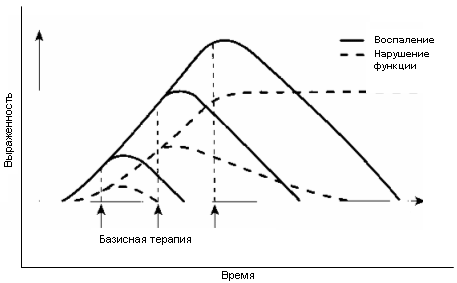
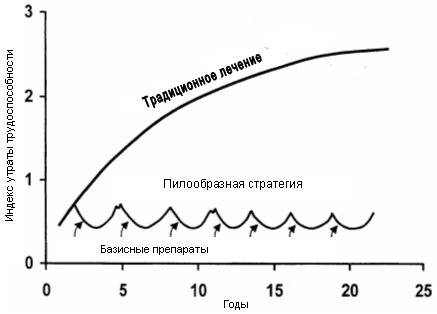
Современная стратегия базисной терапии ревматоидного артритаРезюме. Представлены современные сведения об особенностях патогенеза ранних стадий ревматоидного артрита и обоснованы требования к проведению базисной терапии. Среди качеств, определяющих выбор базисного препарата, помимо приемлемого соотношения эффективности и токсичности, особое внимание уделено, времени развития клинического эффекта. Проведен анализ соответствия этим требованиям традиционных базисных препаратов и нового представителя этого класса соединений – аравы (лефлуномида). Приведены рекомендуемые программы мониторинга токсичности базисных препаратов. Ключевые слова: ревматоидный артрит, лечение, базисные препараты. Базисные (модифицирующие течение болезни) препараты являются основным компонентом медикаментозного лечения ревматоидного артрита (РА), влияющим на течение и исходы заболевания (Abu-Shakra M. et al., 1998; Edworthy S.M., 1999). В последние годы стратегия проведения базисной терапии подверглась существенным изменениям (Van de Putte L.B. et al., 1998; Fries J.F., 2000). Ключевыми моментами новой стратегии являются, во-первых, время начала базисной терапии, которое должно быть максимально приближено к дебюту болезни, во-вторых, использование высокоэффективных препаратов с быстрым началом клинического действия (по отдельности или в комбинации), и в-третьих, проведение лечения базисными препаратами практически непрерывно. Необходимость разработки новых подходов к лечению РА стала очевидной после предпринятого в первой половине 90-х годов всестороннего изучения эффективности использовавшейся ранее стратегии "терапевтической пирамиды", подразумевавшей сначала применение в течение нескольких месяцев нестероидных противовоспалительных препаратов (НПВП) и лишь затем - при прогрессировании болезни – базисных средств. При этом использование базисных препаратов рассматривалось в виде тактики последовательной монотерапии. При таком подходе, если применение базисного препарата не давало клинического эффекта, и/или его назначение приводило к появлению значительных побочных эффектов, препарат заменялся на другой, затем - на третий и так далее. Поскольку все базисные средства являются медленно действующими, то на подбор эффективного лечения уходило много месяцев, а то и годы. Более того, опасение развития токсических эффектов часто приводило к отсрочке назначения базисных препаратов - вплоть до того момента, когда уже появлялись структурные изменения в суставах. По этой же причине их прием нередко прерывался без достаточных оснований. По подсчетам Sherrer Y.S. et al. (1987), больные РА принимали базисные препараты лишь в течение 25-30% времени cуществования заболевания. Как выяснилось, такое лечение имело весьма ограниченный успех. По данным мета-анализа 6 проспективных исследований (Van der Heijde D.M.F.M., 1995), несмотря на проводившуюся терапию, в течение первых 1-2-х лет заболевания костные эрозии возникают у 70% больных. По другим оценкам (Sharp J.T. et al., 1991), за это же время до 90 % пациентов с агрессивным синовитом имеют эрозии. Как следствие, в пределах 20 лет после установления диагноза около 90% больных становятся нетрудоспособными (Buckley C.D., 1997). Такие неудовлетворительные результаты отсроченного, запоздалого применения базисной терапии связаны с особенностями патогенеза ранних и поздних стадий РА. По современным представлениям, ключевая роль в патогенезе воспалительного процесса в суставах принадлежит клону активированных гипотетическим антигеном Т-клеток. Эти клетки путем прямых межклеточных взаимодействий и выработки цитокинов активируют макрофаги, фибробласты, которые в свою очередь продуцируют провоспалительные цитокины, стимулирующие рост и пролиферацию тех же Т-лимфоцитов, а также моноцитов, синовиоцитов, хондроцитов и других эффекторных клеток, выделяющих медиаторы воспаления и непосредственно участвующих в разрушении суставного хряща и кости (Weyand C.M., 2000). В дальнейшем, по мере накопления в синовиальной оболочке генотоксических агентов (кислородные радикалы, продукты пероксидации липидов и белков, оксид азота и др.) происходят повреждение ДНК и генные мутации синовиоцитов, которые после достижения некоего количественного предела приводят к формированию клона неконтролируемо размножающихся, агрессивных синовиоцитов. В этих клетках выявляется, в частности, мутация гена р53, ответственного за подавление опухолевого роста (Firestein G.S. et al., 1997). Активированные, в том числе мутированные, синовиоциты вместе с новообразованными сосудами формируют паннус, обладающий признаками опухолеподобного роста и пенетрирующий в хрящ и подлежащую кость. Как свидетельствуют результаты экспериментальных и клинических исследований, удельный вес описанных составляющих патогенеза ревматоидного синовита в различные сроки заболевания неодинаков: на ранних стадиях основное значение имеет Т-клеточно-макрофагальный механизм с цитокиновым каскадом, а на поздних стадиях доминируют автономные неиммунные механизмы, в основе которых лежит образование клона генотипически измененных синовиоцитов. Отсюда вытекает необходимость применения базисных препаратов, действие которых направлено главным образом на снижение функциональной активности интенсивно пролиферирующих клеток, на ранних стадиях процесса - до формирования паннуса, практически рефрактерного к медикаментозным воздействиям. Ориентировочно на образование паннуса требуется несколько месяцев. Этот своеобразный латентный период между дебютом воспалительного процесса и образованием клона клеток с опухолеподобным ростом и является "терапевтическим окном" – оптимальным сроком для начала базисной терапии. Данное положение было подтверждено в нескольких контролируемых исследованиях, в которых в группах сравнения (отсроченное лечение) пациенты изначально получали плацебо и лишь после выявления различий с тестируемым препаратом или очевидного прогрессирования заболевания им назначалась базисная терапия. Было показано, что при раннем (длительностью менее 1-2 лет) РА безотлагательное базисное лечение по сравнению с отсроченным достоверно уменьшает число отекших и болезненных суставов, лабораторные воспалительные отклонения (Egsmose C. et al., 1995; Van der Heide A. et al., 1996), болевой индекс, функциональные расстройства и индекс нетрудоспособности (по опроснику оценки здоровья – HAQ) (Egsmose C. et al., 1995; Van der Heide A. et al., 1996; Munro R. et al., 1998; Tsakonas E. et al., 2000), а также степень рентгенологического повреждения (Buckland-Wright J.C. et al., 1993; Egsmose C. et al., 1995). В недавно проведенном анализе первичных данных 14 рандомизированных контролируемых исследований по изучению эффективности базисных препаратов у больных РА установлено, что пациенты с большей продолжительностью болезни не имеют такого же хорошего ответа на терапию, как больные, леченные на ранних стадиях заболевания (Anderson J.J. et al., 2000). Весьма показательны данные Ahmed A. и Emery P. (1999), согласно которым при длительности РА менее 12 недель ремиссию возможно индуцировать у 50% больных, в то время как при большей продолжительности заболевания – лишь у 7%. Отсюда вытекает одно из наиболее принципиальных требований к базисной терапии: она должна быть начата не позднее первых 3 месяцев с момента установления диагноза или начала заболевания (ACR Guidelines, 1996, 2002). Своевременно начатая базисная терапия не только позволяет установить контроль над течением заболевания, но и в несколько раз уменьшает последующие финансовые потери (Ahmed A., Emery P., 1999; Kobelt G. et al., 1999) и, что самое важное – способствует сохранению функциональных возможностей опорно-двигательного аппарата. Как видно из рис. 1 (Emery P., 1995), параллелизм между уменьшением выраженности воспаления и улучшением функции суставов в ответ на базисную терапию наблюдается только на ранних стадиях болезни. В дальнейшем если и удается индуцировать лечением снижение активности воспалительного процесса, то степень восстановления функциональных нарушений с увеличением длительности болезни уменьшается. Таким образом, раннее начало базисной терапии является необходимым условием для предотвращения в последующем стойких нарушений функции. Базисные препараты позволяют управлять течением РА, но не излечивают болезнь. По этой причине, если достигнут контроль над активностью заболевания, прием препаратов должен продолжаться в поддерживающей дозе неопределенно длительное время. Прерывание базисной терапии может привести к обострению РА, а повторное назначение того же препарата, как правило, безуспешно (Wolde S.T. et al., 1996; ACR Guidelines, 1996). Принятое ранее понятие некоторой "достаточной" дозы, дозы насыщения (например, для препаратов золота), после достижения которой препарат мог быть отменен, утратило свое значение. С учетом вышеизложенного современная лечебная парадигма РА подразумевает более раннее и более постоянное, настойчивое применение базисных препаратов, чем следовало из тактики "терапевтической пирамиды" (Irvine S. et al., 1999; Fries J.F., 2000). Базисная терапия назначается как можно раньше после начала РА и продолжается в течение всего заболевания. Как только достигнутый положительный результат идет на убыль, терапевтический режим изменяется путем замены базисного препарата или добавления нового лекарственного средства. Только такая стратегия, которую по внешнему виду ее графического изображения предложено называть "зубьями пилы", может способствовать достижению основной цели лечения – существенного улучшения отдаленных результатов и сохранения определенного уровня трудоспособности больных (Fries J.F., 2000) (Рис. 2). Необходимость пилообразной стратегии связана с проблемой развития вторичной рефрактерности, ускользания из-под действия базисных препаратов. Более чем у половины пациентов препарат утрачивает эффективность в период от 2 до 5 лет (Young A., 1995; Weinblatt M.E. et al., 1998). Нет ни одного препарата, эффективного на протяжении всего заболевания. Поэтому больные РА должны лечиться с использованием многих базисных средств, применяемых либо последовательно, либо в комбинации. Более высокая эффективность комбинированной базисной терапии по сравнению с монотерапией продемонстрирована в ряде исследований (O'Dell J.R. et al., 1996; Boers M. et al., 1997; Keysser G. et al., 1999; Mottonen T. et al., 1999). При этом ни в одной работе не отмечено увеличения количества и тяжести побочных эффектов. Получены также данные о том, что у тех же пациентов средняя длительность эффективного лечения достоверно больше при комбинированной терапии, чем при предшествующей монотерапии (Keysser G. et al., 1999). Наиболее часто используемыми комбинациями базисных препаратов являются следующие: метотрексат + плаквенил; метотрексат + сульфасалазин; метотрексат + сульфасалазин + плаквенил. Они применяются при высокой активности и плохом прогнозе РА, недостаточном эффекте или отсутствии такового при назначении отдельных базисных препаратов (ACR Guidelines, 1996, 2002; Isaacs J.D., Moreland L.W., 2002). В целом же применение пилообразной стратегии базисной терапии позволяет добиться ремиссии РА примерно в 30% случаев, что существенно выше, чем при традиционном лечении (Mottonen T. et al., 1996). Новый, агрессивный подход к базисной терапии предъявляет повышенные требования к базисным препаратам. В пересмотренных в 2002 году Рекомендациях по ведению больных РА Американской коллегии ревматологов (ACR Guidelines, 2002) среди основных факторов, определяющих выбор базисного средства, названы сравнительная эффективность, время ожидаемого развития клинического эффекта, удобство приема, частота и серьезность побочных реакций, требования программ мониторинга, стоимость препарата и мониторинга. Быстрое начало клинического действия – одно из важнейших качеств этих препаратов, особенно в дебюте заболевания. В таблице 1 суммированы некоторые данные о базисных препаратах для лечения РА (сведения о биологических агентах – этанерцепте и инфликсимабе, а также иммуносорбции на стафилококковом протеине А не приводятся, поскольку по разным причинам, прежде всего экономическим, на Украине они практически не применяются). Как видно из этих данных, наиболее быстродействующими препаратами являются арава, сульфасалазин и метотрексат. Арава (лефлуномид) – новое базисное средство, по химическому строению дериват изоксазола, оказывающий иммуномодулирующее действие благодаря ингибиции синтеза пиримидинов. В трех крупных рандомизированных исследованиях (североамериканском – US301 и двух международных - MN301/303/305 и MN302/304), охвативших в общей сложности 1839 больных, доказана высокая эффективность аравы и, в частности, более быстрое по сравнению с метотрексатом и сульфасалазином начало клинического действия (Strand V. et al., 1999а; Schiff M.H. et al., 2000). Так, через 4 недели терапии улучшение (по критерию ACR20%) отмечено у 30,8% больных, получавших араву, и лишь у 18,9% больных, получавших сульфасалазин (р<0,03); при сравнении с метотрексатом – соответственно у 23,6% и 18% больных (р<0,03). Интересно, что в эти сроки количество больных, ответивших на лечение метотрексатом и сульфасалазином, существенно не отличалось от группы плацебо-контроля, в то время как при приеме аравы оно было достоверно выше (в 1,9-3,5 раза по сравнению с плацебо). Таблица 1. Характеристика основных базисных препаратов для лечения РА
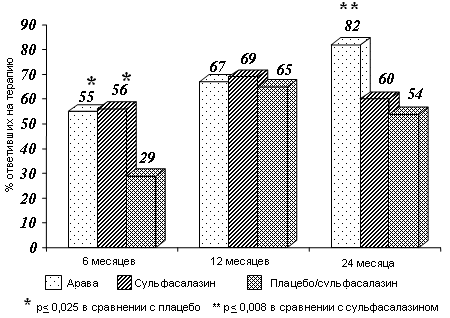
Следующий принципиально важный мотив выбора базисного препарата - соотношение эффективности и токсичности. Согласно результатов проведенного Felson D.T. et al. (1992) мета-анализа, включавшего 4904 больных РА, из старых препаратов наиболее эффективными являются метотрексат, сульфасалазин, D-пеницилламин и парентеральные препараты золота. Однако при применении метотрексата и сульфасалазина в несколько раз реже встречаются серьезные побочные эффекты. Плаквенил, пероральные препараты золота и азатиоприн значительно уступают названным препаратам по эффективности. За прошедшие 10 лет ситуация существенно не изменилась. Из-за худшего соотношения эффективности и токсичности, а также длительного «латентного периода» действия препараты золота, D-пеницилламин, азатиоприн отодвинуты на резервные позиции и все реже используются в ревматологической практике. Напротив, метотрексат и сульфасалазин наиболее широко применяются в лечении больных РА и являются своего рода эталонами, с которыми сравнивают эффективность и безопасность новых препаратов (Weinblatt M.E. et al., 1998; Matteson E.L., 2000; Aletaha D. et al., 2002; ACR Guidelines, 2002). При сравнении с обоими этими эталонными препаратами арава демонстрирует сравнимую клиническую эффективность через 6 и 12 месяцев лечения. В более поздние сроки - через 2 года она оказалась даже более эффективной: количество больных, ответивших на лечение по критерию АСR20%, составило 79% (исследование US301) - 82% (исследование MN301/303/305), что достоверно выше по сравнению и с метотрексатом – 67% (р<0,05), и с сульфасалазином – 60% (р<0,008) (Cohen S. et al., 1999; Smolen J.S. et al., 1999; Kalden J.R. et al., 1999; Emery P. et al., 2000). C практической точки зрения важно подчеркнуть, что с увеличением длительности лечения эффективность аравы нарастала (от 55% через 6 месяцев до 82% через 24 месяца), в отличие от сульфасалазина, лечебный эффект которого был по сути стабильным (Рис. 3). При субанализе материалов исследований US301 и MN301/303/305 была оценена эффективность аравы в зависимости от длительности РА, что имеет принципиальное значение при выборе базисного препарата на разных стадиях заболевания. Оказалось, что лечение аравой одинаково эффективно как при раннем (длительностью до 2 лет), так и при позднем РА (Moreland L.W., Fleischmann R.M., 1998; Scott D.L. et al., 1998). Сравнение базы данных по араве с результатами мета-анализа эффективности других базисных средств (Anderson J.J. et al., 2000) демонстрирует ощутимые преимущества нового препарата. Так, на традиционные базисные средства при длительности РА менее 1 года отвечают 52% больных, затем эффективность лечения снижается и при длительности болезни более 10 лет эта цифра составляет всего лишь 35%. Эффективность же аравы практически не меняется: больные с длительностью РА до 1 года и более 10 лет отвечают на лечение соответственно в 60% и 52% случаев. В зарубежных исследованиях при оценке эффективности терапии большое внимание уделяется не только объективным клиническим и лабораторным признакам воспаления, но и изменениям физического состояния больных - способности к самообслуживанию и профессиональной деятельности. Изучение опросника оценки здоровья (HAQ) показало, что арава достоверно улучшает функциональное состояние и качество жизни больных по сравнению с плацебо во все сроки наблюдения – через 4 недели, 6 месяцев и 2 года. Улучшение большинства категорий HAQ и суммарного индекса нетрудоспособности (HAQ – DI) через 2 года оказалось достоверно более выраженным по сравнению с обоими препаратами – метотрексатом (Strand V. et al., 1999б; Tugwell P. et al., 1999) и сульфасалазином (Smolen J.S. et al., 1999; Smolen J.S., Emery P., 2000). “Золотым стандартом” при оценке эффективности базисной терапии является отсутствие или замедление рентгенологических признаков прогрессирования РА. Хотя все причисляемые к базисным препараты уменьшают клинические проявления заболевания, однако только в отношении 4 из них – сульфасалазина, метотрексата, аравы и миноциклина - в рандомизированных исследованиях доказана способность замедлять рентгенологическое прогрессирование РА по сравнению с плацебо (ACR Guidelines, 2002) (табл. 2). Уже через 1 год лечения арава в 4 раза по сравнению с плацебо уменьшала признаки прогрессирования РА по рентгенологической шкале Шарпа (Sharp J.T. et al., 2000). Это улучшение было достоверно более выраженным по сранению с метотрексатом (Strand V. et al., 1999a). В исследовании MN301/303/305 показано, что арава и сульфасалазин в одинаковой степени в сравнении с плацебо замедляют формирование эрозий и общую рентгенологическую прогрессию по шкале Ларсена (Smolen J.S. et al., 1999). Таблица 2. Доказанные в контролируемых рандомизированных исследованиях данные об эффективности базисных препаратов при РА (по материалам ACR Guidelines, 2002)
+ Доказано положительное влияние; - нет положительного влияния или нет данных. В скобках - количество исследований (публикаций), в которых доказано данное влияние. ССЗ – сульфасалазин, МТ – метотрексат, АзТ – азатиоприн. Что же касается побочных эффектов, то во всех клинических исследованиях арава продемонстрировала приемлемый профиль безопасности (Strand V. et al., 1999a; Smolen J.S. et al., 1999; Emery P. et al., 2000; Simon L.S., Yocum D., 2000). Как видно из таблицы 3, по числу серьезных побочных эффектов и числу случаев прекращения лечения из-за побочных эффектов арава, метотрексат и сульфасалазин существенно не различаются. Таблица 3. Частота серьезных осложнений при применении аравы, метотрексата и сульфасалазина (по данным исследований US301, MN301/303/305 и MN302/304)
Наиболее частыми побочными эффектами аравы являются диарея, тошнота, кожная сыпь и обратимая алопеция. Впервые развившаяся артериальная гипертензия на фоне приема аравы, метотрексата и сульфасалазина регистрировалась с одинаковой частотой – соответственно 2,1%, 1,6% и 2% (Simon L.S., Yocum D., 2000; Smolen J.S., Emery P., 2000). Препараты также в среднем не различались по частоте повышения активности печеночных ферментов. Лечение аравой не сопровождается гематологическими, легочными и почечными осложнениями. В то же время у больных, принимавших сульфасалазин, наблюдалось 2 случая агранулоцитоза, а на фоне лечения метотрексатом зарегистрировано 4 случая интерстициального пневмонита и 1 случай интерстициального фиброза. В отличие от других базисных препаратов, арава не повышает частоту интеркуррентных инфекций, то есть не угнетает неспецифическую иммунную защиту. Это объясняется уникальным механизмом действия препарата. Активный метаболит аравы ингибирует дегидрооротат-дегидрогеназу - ключевой фермент синтеза пиримидинов (РНК и ДНК) "de novo". Т-лимфоциты и макрофаги, являющиеся центральным звеном патогенеза РА, не имеют достаточного запаса пиримидинов и в условиях активации вынуждены синтезировать их "de novo". Поэтому пул этих активированных клеток особо чувствителен к араве и является основным объектом ее действия. На клетки с нормальной функциональной активностью препарат не влияет. Иными словами, арава является иммуномодулирующим, а не цитотоксическим агентом (Fox R.I., 1998). Эта особенность препарата нашла отражение в рекомендациях Американской коллегии ревматологов (ACR Guidelines, 2002) по мониторингу токсичности базисных препаратов (табл. 4): в отличие от других базисных средств, при лечении аравой миелосупрессия не фигурирует среди ожидаемых побочных эффектов. Лабораторный мониторинг для аравы идентичен таковому для метотрексата. Учитывая современные тенденции более частого использования комбинированной базисной терапии, было проведено два исследования по оценке эффективности и безопасности комбинации аравы с метотрексатом у больных РА с недостаточным эффектом от предшествующего лечения метотрексатом (Weinblatt M.E. et al., 1999; Kremer J.M. et al., 2000). В обоих исследованиях добавление аравы значительно повышало эффективность лечения. В открытом исследовании (Weinblatt M.E. et al., 1999) через 1 год улучшение по критерию ACR20% зарегистрировано у 53% больных, а у 7% достигнута ремиссия. В двойном слепом плацебо-контролируемом исследовании (Kremer J.M. et al., 2000) через 6 месяцев на лечение по критерию ACR20% ответили 51,5% пациентов, что достоверно больше, чем в группе больных, получавших метотрексат + плацебо (рис. 4). Таким образом, современная стратегия лечения РА требует раннего назначения и настойчивого применения высокоэффективных и быстродействующих базисных препаратов с хорошей переносимостью, минимальным количеством опасных для жизни осложнений. Из традиционных базисных препаратов эти качества в наибольшей мере присущи метотрексату и сульфасалазину. Как свидетельствуют результаты многоцентровых рандомизированных контролируемых исследований, соответствующих самым высоким категориям доказательной медицины – Іа и Ів (Shekelle P.G. et al., 1999), новый препарат с уникальным иммуномодулирующим механизмом действия – арава (лефлуномид) в полной мере отвечает современным требованиям, предъявляемым к базисным средствам для лечения РА. Препарат проявляет по меньшей мере такую же эффективность, как метотрексат и сульфасалазин, а при длительном применении по способности уменьшать клинические признаки заболевания, замедлять рентгенологическое прогрессирование и улучшать качество жизни больных даже превосходит их. Быстрое начало действия, стабильная эффективность при различной длительности заболевания, приемлемый профиль переносимости и безопасности – дополнительные аргументы в пользу заключения о том, что арава может рассматриваться как препарат выбора для стартовой базисной терапии РА или как препарат второго ряда при недостаточной эффективности метотрексата и сульфасалазина. Таблица 4. Рекомендуемый мониторинг токсичности базисных препаратов
* Симптомы миелосупрессии включают лихорадку, признаки инфекции, появление синяков при незначительных травмах, кровоточивость. ОАК – общий анализ крови, ОАМ – общий анализ мочи, АЛТ – аланинаминотрансфераза, АСТ – аспартатаминотрансфераза. ЛИТЕРАТУРА:
Abu-Shakra M., Toker R., Flusser D. et al. (1998) Clinical and radiographic outcomes of rheumatoid arthritis patients not treated with disease-modifying drugs. Arthritis Rheum., 41: 1190-1195. Ahmed K., Emery P. (1999) A case for early aggressive therapy. In: Bird H.A., Snaith M.L. (Еds.) Challenges in Rheumatoid Arthritis. Blackwell Science, Oxford, England, pp. 106-115. Aletaha D., Eberl G., Nell V.P.K. et al. (2002) Practical progress in realisation of early diagnosis and treatment of patients with suspected rheumatoid arthritis: results from two matched questionnaires within three years. Ann. Rheum. Dis., 61: 630-634. American College of Rheumatology Ad Hoc Committee on Clinical Guidelines. (1996) Guidelines for the management of rheumatoid arthritis. Arthritis Rheum., 39: 713 -722. American College of Rheumatology Subcommittee on Rheumatoid Arthritis Guidelines. (2002) Guidelines for the management of rheumatoid arthritis. 2002 Update. Arthritis Rheum., 46: 328-346. Anderson J.J., Wells G., Verhoeven A.C., Felson D.T. (2000) Factors predicting response to treatment in rheumatoid arthritis. The importance of disease duration. Arthritis Rheum., 43: 22-29. Boers M., Verhoeven A.C., Markusse H.M. et al. (1997) Randomized comparison of combined step-down prednisolone, methotrexate and sulfasalazine with sulfasalazine alone in early rheumatoid arthritis. Lancet, 350: 309-318. Buckland-Wright J.C., Clarke G.S., Chikanza I.C., Grahame R. (1993) Quantitative microfocal radiography detects changes in reosion area in patients with early rheumatoid arthritis treated with myocrisine. J. Rheumatol., 20: 243-247. Buckley C.D. (1997) Science, medicine, and the future: Treatment of rheumatoid arthritis. Brit. Med. J., 315: 236-238. Cohen S., Weaver A., Schiff M., Strand V. (1999) Two-year treatment of active rheumatoid arthritis (RA) with leflunomide (LEF) compared with placebo (PL) or methotrexate (MTX). Arthritis Rheum., 42 (Suppl. 9): S271. Edworthy S.M. (1999) Morning stiffness: sharpening an old saw? J. Rheumatol., 26: 1015-1017. Egsmose C., Lund B., Borg G. et al. (1995) Patients with rheumatoid arthritis benefit from early 2nd line therapy: 5 year follow-up of a prospective double blind placebo controlled study. J. Rheumatol., 22: 2208-2213. Emery P. (1995) Early rheumatoid arthritis: time to aim for remission? Ann. Rheum. Dis., 54: 944-947. Emery P., Breedveld F.C., Lemmel E.M. et al. (2000) A comparison of the efficacy and safety of leflunomide and methotrexate for the treatment of rheumatoid arthritis. Rheumatology, 39: 655-665. Felson D.T., Anderson J.J., Meenan R.F. (1992) Use of short-term efficacy/toxicity tradeoffs to select second-line drugs in rheumatoid arthritis. A metaanalysis of published clinical trials. Arthritis Rheum., 35: 1117-1125. Firestein G.S., Echeverri F., Yeo M. et al. (1997) Somatic mutations in the p53 tumor supressor gene in rheumatoid arthritis synovium. Proc. Natl.Acad. Sci. USA, 94: 10895-10900. Fries J.F. (2000) Current treatment paradigms in rheumatoid arthritis. Rheumatology, 39 (Suppl. 1): 30-35. Fox R.I. (1998) Mechanism of action of leflunomide in rheumatoid arthritis. J. Rheumatol., 25 (Suppl. 53): 20-26. Irvine S., Munro R., Porter D. (1999) Early referral, diagnosis, and treatment of rheumatoid arthritis: evidence for changing medical practice. Ann. Rheum. Dis., 58: 510-513. Isaacs J.D., Moreland L.W. (2002) Rheumatoid arthritis. Health press, Oxford, 96 p. Kalden J.R., Schattenkirchner M., Smolen J.S. et al. (1999) Leflunomide vs sulphasalazine in rheumatoid arthritis: 24-month update of a randomized, double-blind study. Arthritis Rheum., 42 (Suppl. 9): S271. Keysser G., Keysser C., Keysser M. (1999) Efficacy and safety of a combination therapy of methotrexate, chloroqume and cyclophosphamide in patients with refractory rheumatoid arthritis: results of an observational study with matched-pair analysis. Clin. Rheumatol., 18: 145-151. Kobelt G., Eberhardt K., Jonsson L., Jonsson B. (1999) Economic consequencesof the progression of rheumatoid arthritis in Sweden. Arthritis Rheum., 42: 347-356. Kremer J.M., Caldwell J.R., Cannon G.W. et al. (2000) The combination of leflunomide and methotrexate in patients with active rheumatoid arthritis who are failing on methotrexate treatment alone: a double-blind placebo controlled study. Arthritis Rheum., 43 (Suppl. 9): S224. Matteson E.L. (2000) Current treatment strategies for rheumatoid arthritis. Mayo Clin. Proc., 75: 69-74. Moreland L.W., Fleischmann R.M. (1998) Efficacy of leflunomide vs placebo in early and late rheumatoid arthritis. Arthritis Rheum., 41 (Suppl.): S155. Mottonen T., Hannonen P., Leirisalo-Repo M. et al. (1999) Comparison of combination therapy with single-drug therapy in early rheumatoid arthritis: a randomised trial. Lancet, 353: 1568-1573. Mottonen T., Paimela L., Ahonen J. et al. (1996) Outcome in patients with early rheumatoid arthritis treated according to the "sawtooth" strategy. Arthritis Rheum., 39: 996-1005. Munro R., Hampson R., McEntegart A. et al. (1998) Improved functional outcome in patients with early rheumatoid arthritis treated with intramuscular gold: results of a five year prospective study. Ann. Rheum. Dis., 57: 88-93. O'Dell J.R., Haire C.E., Erikson N. et al. (1996) Treatment of rheumatoid arthritis with methotrexate alone, sulfasalazine and hydroxychloroquine, or a combination of all three medications. N. Engl. J. Med., 334: 1287-1291. Schiff M.H., Strand V., Oed C. et al. (2000) Leflunomide: efficacy and safety in clinical trials for the treatment of rheumatoid arthritis. Drugs Today, 36: 383-394. Scott D.L., Schattenkirchner M., Smolen J.S. et al. (1998) Efficacy of leflunomide vs placebo vs sulphasalazine in rheumatoid arthritis: effect of disease duration. Arthritis Rheum., 41 (Suppl.): S155. Sharp J.T., Wolfe F., Mitchell D.M., Bloch D.A. (1991) The progression of erosion and joint space narrowing scores in rheumatoid arthritis during the first twenty-five years of disease. Arthritis Rheum., 34: 660-667. Sharp J.T., Strand V., Leung H. et al. (2000) Treatment with leflunomide slows radiographic progression of rheumatoid arthritis: results from three randomized controlled trials of leflunomide in patients with active rheumatoid arthritis. Arthritis Rheum., 43: 495-505. Shekelle P.G., Woolf S.H., Eccles M., Grimshaw J. (1999) Clinical guidelines: developing guidelines. Brit. Med. J., 318: 593-596. Sherrer Y.S., Bloch D.A., Mitchell D.L. et al. (1987) Disability in rheumatoid arthritis: comparison of prognostic factors across three population. J. Rheumatol., 14: 705-709. Simon L.S., Yocum D. (2000) New and future drug therapies for rheumatoid arthritis. Rheumatology, 39 (Suppl. 1): 36-42. Smolen J.S., Kalden J.R., Scott D.L. et al. (1999) Efficacy and safety of leflunomide compared with placebo and sulphasalazine in active rheumatoid arthritis: a double-blind, randomised, multicentre trial. Lancet, 353: 259-266. Smolen J.S., Emery P. (2000) Efficacy and safety of leflunomide in active rheumatoid arthritis. Rheumatology, 39 (Suppl. 1): 48-56. Strand V., Cohen S., Schiff M. et al. (1999a) Treatment of active rheumatoid arthritis with leflunomide compared to placebo and methotrexate. Arch. Intern. Med., 159: 2542-2550. Strand V., Tugwell P., Bombardier C. et al. (1999б) Function and health-related quality of life. Results from a randomized controlled trial of leflunomide versus methotrexate or placebo in patients with active rheumatoid arthritis. Arthritis Rheum., 42: 1870-1878. Tsakonas E., Fitzgerald A.A., Fitzcharles M.A. et al. (2000) Consequences of delayed therapy with second-line agents in rheumatoid arthritis: a 3 year follow-up on the hydroxychloroquine in early rheumatoid arthritis (HERA) study. J. Rheumatol., 27: 623-629. Tugwell P., Bombardier C., Strand V. et al. (1999) Two-year treatment of active rheumatoid arthritis (RA) with leflunomide (LEF) improves function and health-related quality of life (HRQOL). Arthritis Rheum., 42 (Suppl. 9): S82. Van de Putte L.B., van Gestel A.M., van Riel P.L. (1998) Early treatment of rheumatoid arthritis: rationale, evidence, and implications. Ann. Rheum. Dis., 57: 511-512. Van der Heide A., Jacobs J.W.G., Bijlsma J.W.J. et al. (1996) The effectiveness of early treatment with "second-line" antirheumatic drugs: a randomized, controlled trial. Ann. Intern. Med., 124: 699-707. Van der Heijde D.M.F.M. (1995) Joint erosions and patients with early rheumatoid arthritis. Brit. Med. J., 34 (Suppl. 2): 74-78. Weinblatt M.E., Maier A.L., Fraser P.A. et al. (1998) Longterm prospective study of methotrexate in rheumatoid arthritis: conclusion after 132 months of therapy. J. Rheumatol., 25: 238-242. Weinblatt M.E., Kremer J.M., Coblyn J.S. et al. (1999) Pharmacokinetics, safety, and efficacy of combination treatment with methotrexate and leflunomide in patients with active rheumatoid arthritis. Arthritis Rheum., 42: 1322-1328. Weyand C.M. (2000) New insights into the pathogenesis of rheumatoid arthritis. Rheumatology, 39 (Suppl.1): 3-8. Wolde S.T., Breedveld F.C., Hermans J. et al. (1996) Randomised placebo controlled study of stopping second-line drugs in rheumatoid arthritis. Lancet, 347: 347-352. Young A. (1995) Short-term outcomes in recent-onset rheumatoid arthritis. Brit. J. Rheumatol., 34 (Suppl. 2): 79-86. О.Б. Яременко Резюме. Подано сучасні відомості про особливості патогенезу ранніх стадій ревматоїдного артриту і обгрунтовано вимоги до проведення базисної терапії. Серед якостей, що визначають вибір базисного препарату, особлива увага приділена, крім прийнятного співвідношення ефективності і токсичності, часу розвитку клінічного ефекту. Проведено аналіз відповідності цим вимогам традиційних базисних препаратів і нового представника цього класу сполук - арави (лефлуноміда). Наведено рекомендовані програми моніторингу токсичності базисних препаратів. Ключові слова: ревматоїдний артрит, лікування, базисні препарати.
O.B. Yaremenko Summary. The modern items of information on pathogenesis features of early stages of rheumatoid arthritis are submitted and the requirements to realization of disease-modifiyng therapy are reasonable. Among qualities determining a choice of a disease-modifiyng drugs, the special attention is given, besides an acceptable ratio of efficiency and toxicity, time of development of clinical effect. The analysis of conformity to these requirements of old disease-modifiyng drugs and new representative of this class of preparations - arava (leflunomide) is carried out. The recommended monitoring programs of toxicities of disease-modifiyng drugs are given. Key words: rheumatoid arthritis, treatment, disease-modifying drugs.
Рисунок 1. Зависимость ответа на базисную терапию от длительности РА.
Рисунок 2. Современная парадигма базисной терапии РА.
Рисунок 3. Эффективность лечения аравой и сульфасалазином в динамике 2-летнего наблюдения. comments powered by Disqus |
Powered by Disqus
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||