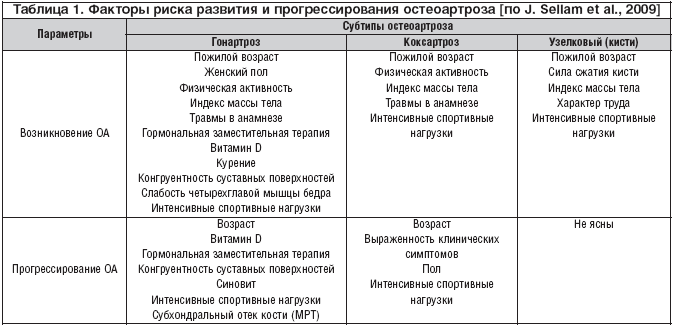
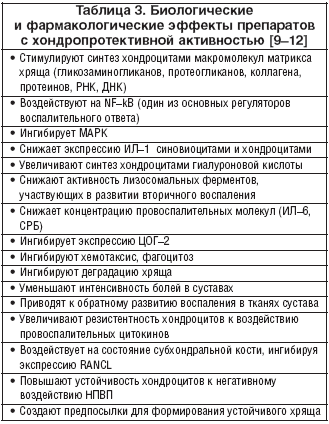
Существуют ли хондропротективные препараты?Остеоартроз [ОА] является наиболее распространенным заболеванием опорно–двигательного аппарата [1]. Более 70% людей в возрасте 65 лет и старше имеют клинические или рентгенологические симптомы этого заболевания. ОА приводит к значительному нарушению качества жизни, стойкой инвалидизации больных прежде всего из–за прогрессирующего ограничения подвижности «несущих» (коленных и тазобедренных) суставов. Хотя ОА непосредственно не влияет на жизненный прогноз, он является одной из основных причин преждевременной потери трудоспособности и инвалидности, уступая в этом отношении только ишемической болезни сердца. По данным ВОЗ, только ОА коленных суставов находится на четвертом месте среди основных причин нетрудоспособности у женщин и на восьмом – у мужчин. В основе ОА лежит нарушение равновесия между анаболическими и катаболическими процессами в тканях сустава, и в первую очередь в гиалиновом хряще – главном плацдарме патологических изменений. Облигатной чертой ОА является дегенерация суставного (гиалинового) хряща, обусловленная недостаточным синтезом хондроцитами протеогликанов и фрагментацией протеогликановых агрегатов – основных составляющих патологических нарушений при этом заболевании. В реализации этих изменений участвуют как клеточные факторы, так и растворимые медиаторы [2]. Клеточные факторы – это хондроциты, остеоциты и остеобласты субхондральной кости, синовиоциты и мононуклеарные клетки синовиальной оболочки. Растворимые медиаторы вырабатываются хондроцитами, а также синовиоцитами и инфильтрирующими мононуклеарными клетками. К ним относятся провоспалительные цитокины, протеиназы, оксид азота и липидные медиаторы (лептин, адипонектин, вистатин, резистин). Адипокины являются новым классом растворимых медиаторов, которые участвуют в деградации хряща. Субхондральные остеобласты также способны продуцировать растворимые медиаторы, такие как инсулиновый фактор роста–1 (IGF–1), трасформирующий фактор роста–β (TGF–β), ИЛ–6, липидные медиаторы, протеиназы, фрагменты фибронектина и нейропептиды. Хотя ОА рассматривается в качестве основного дегенеративного заболевания суставов, однако имеются убедительные данные, позволяющие рассматривать его, как нозологическую форму, в патогенезе которой важная, а возможно, и определяющая, роль принадлежит персистирующему воспалению в тканях сустава. Это воспаление способствует прогрессированию морфологических изменений, в том числе прогрессированию структурных изменений гиалинового хряща с его дегенерацией и уменьшением объема. Чем обусловлены воспалительная и катаболическая компоненты в патогенезе остеоартроза? В настоящее время получены веские доказательства, подтверждающие влияние провоспалительных медиаторов на метаболизм клеток гиалинового хряща и течение ОА [3]. Среди медиаторов, ответственных за прогрессирование этого заболевания, ключевую роль играют интерлейкин–1β (IL–1β), который экспрессируется в пораженном остеоартрозом хряще и стимулирует выработку металлопротеиназ (ММП). В реализации деструкции хряща при первичном ОА решающее значение имеет гиперпродукция хондроцитами и другими клетками ММП, включая коллагеназы (ММП–1,8,13), агреканазы (ADAMTS–4 и ADAMT–S5), стромелизина–1 (ММР–3) и желатиназы (ММР –2,9). IL–1β тормозит экспрессию ингибиторов ММП, синтез коллагена и протеогликанов, экспрессирует активатор плазминогена, и в то же время стимулирует синтез и высвобождение некоторых эйкозаноидов, включая простагландины и лейкотриены. Он стимулирует продукцию других провоспалительных цитокинов (ИЛ–6, ИЛ–8) и определяет уровень катаболического процесса при ОА. Определение факторов риска развития и прогрессирования ОА имеет прямое отношение к первичной и вторичной его профилактике (табл. 1) [2]. Эти факторы подразделяются на модифицированные, которые могут быть подвергнуты коррекции, и немодифицированные, на которые невозможно активно воздействовать. Наибольшее значение среди немодифицированных факторов имеет пол, возраст больных, врожденные нарушения (гипермобильность, дисплазия, нестабильность) и генетические факторы, включая патологию гена коллагена II типа, семейную агрегацию ОА. Пол больных оказывает существенное влияние на локализацию этого заболевания. У женщин намного чаще встречается ОА дистальных и проксимальных суставов кистей, а также коленных и тазобедренных суставов (при ОА соотношение мужчин и женщин в целом составляет 1:2–1:3, а только коксартроза – 1:7). У них наблюдается и более яркая как рентгенологическая, так и клиническая симптоматика. Генетические ассоциации при ОА пока что трудно интерпретировать, но все же идиопатический ОА можно рассматривать с позиций полигенного заболевания с различными фенотипами. При генерализованном ОА выявлен полиморфизм гена II типа коллагена (COL2A1), локализующегося на 12–й хромосоме, а также гены полиморфизма ИЛ–1 и ИЛ–1RA, определяющие высокий уровень секреции ИЛ–1 и низкий – ИЛ–1RA [4]. К факторам риска как первичного, так и вторичного ОА относятся также ожирение, травма суставов, слабость четырехглавой мышцы бедра, механические факторы (вальгусная или варусная деформация), гипермобильный синдром, нарушения проприоцепции, врожденные дефекты, включая болезнь Пертеса или дисплазию тазобедренного сустава, особенно предрасполагающую к развитию коксартроза. Немаловажное значение имеет плоскостопие, которое значительно повышает нагрузку на коленный сустав и способствует прогрессированию гонартроза. К факторам риска относятся также метаболические заболевания суставов, эндокринные болезни (сахарный диабет, гиперпаратиреоидизм, гипотиреоидизм), а также воспалительные заболевания суставов. Что касается факторов, способствующих быстрому прогрессированию ОА, то к ним относятся, помимо вышеперечисленных, пожилой возраст, женский пол, ожирение, диета с низким содержанием витамина С или витамина D3. Важное значение придается механическому стрессу, который приводит к активации интегрин рецептора (механорецептора), экспрессии митоген–активированного белка – киназы (MAPK) и ядерного фактора–kappa B (NF–кB) [5]. ОА характеризуется снижением объема хряща в синовиальных суставах, гипертрофией кости с формированием остеофитов, склерозом субхондральной кости и утолщением капсулы. В патологический процесс вовлекаются и другие ткани сустава. Нередко наблюдается рецидивирующий синовит со стертой клинической картиной, энтезиты, костное ремоделирование, заинтересованность энтезисов, периартикулярная мышечная атрофия, дегенерация менисков и изменения в нейросенсорной системе. Такие изменения возможны в любом суставе, но наиболее характерны для суставов кистей с поражением дистальных, проксимальных межфаланговых суставов и 1–го запястно–пястного сустава (ризартроз Форестье), стоп, позвоночника, а также коленного и тазобедренного суставов. Клиническая картина ОА связана с его локализацией, тяжестью поражения и числом пораженных суставов. Боль в суставах представляет собой наиболее значимое проявление ОА и часто является его первым симптомом. Она поддается количественной оценке и является адекватным показателем эффективности лечения. Боль обычно продолжительная и носит механический характер, усиливаясь при физической нагрузке или к концу дня. Но боль при этом заболевании может быть и воспалительного типа, что обычно наблюдается при присоединении вторичного артрита. При гонартрозе боль возникает при ходьбе, особенно по лестнице, при долгом стоянии, длительной физической нагрузке и локализуется по передней и медиальной поверхности коленного сустава. С нарастанием прогрессирования боль возникает при малейшем движении или даже в покое, а также во время сна. По своей интенсивности боль обычно легкая или умеренная, но возможно появление интенсивных болей, которые связаны с воспалением внутрисуставных связок и сухожилий, растяжением капсулы, заинтересованностью в патологическом процессе кости (периостит, субхондральные переломы, повышение внутрикостного давления), синовиальной оболочки (воспаление, раздражение чувствительных нервных окончаний остеофитами) и периартикулярных тканей (мышечный спазм, нестабильность сустава). Возможны и другие факторы ее развития, например, неравномерное распределение нагрузки на различные отделы суставов, дегенеративные изменения в периартикулярных тканях, нарушение кровообращения суставов, как и проявление вторичной фибромиалгии. Второй наиболее значимый симптом ОА – ограничение активных и пассивных движений в суставе, приводящее к снижению повседневной активности больного. Это является следствием мышечного спазма, травматизации тканей остеофитами или же вызвано внутрисуставными (например, хондроидными) включениями. Ограничение пассивных движений может быть первым и единственным признаком симптоматического ОА. Утренняя скованность обычно наблюдается в продвинутой стадии болезни, при этом ее длительность не превышает 15–30 мин. Ригидность может быть не только в утренние часы, но и во второй половине дня после периода физического покоя («стартовые боли»), что чаще наблюдается у больных с вторичным (реактивным) артритом. Из симптом–модифицирующих препаратов замедленного действия первостепенное значение принадлежит естественным компонентам хрящевого межклеточного матрикса – глюкозамину и хондроитину сульфату, которые принадлежат к естественным компонентам хрящевого межклеточного вещества. Они наиболее изучены среди препаратов этой группы и имеют солидную доказательную базу их терапевтической активности [6,7]. Их относят к противоартрозным средствам. Они характеризуются медленным развитием лечебного действия с подавлением боли и улучшением функционального состояния пораженных суставов, которое обычно наступает после 2–4 нед терапии. Кроме того, им присуще выраженное последействие с сохранением достигнутого терапевтического эффекта в течение 4–8 и более нед после прекращения приема. Препараты этой группы обладают и потенциальными структурно–модифицирующими (хондропротективными) свойствами, что было подтверждено на Всемирном конгрессе по остеоартрозу в сентябре 2010 г. [8]. Глюкозамин и хондроитин сульфат не только подавляют основные клинические проявления ОА, но и замедляют темпы его прогрессирования, нормализуют или стабилизируют структурные изменения в гиалиновом хряще, предупреждают изменения в непораженных суставах (табл. 3). Наиболее солидную доказательную базу имеет глюкозамин. Он является моносахаридом и естественным компонентом гликозаминогликанов суставного матрикса и синовиальной жидкости. Глюкозамин обладает специфическим влиянием на остеоартритический хрящ и стимулирует синтез хондроцитами полноценного экстрацеллюлярного матрикса, и прежде всего наиболее важных его составляющих – протеогликанов, и гиалуроновой кислоты. Он снижает активность катаболических энзимов в хряще, включая матриксные металлопротеиназы (ММП), подавляет синтез оксида азота, стимулирует синтез хондроитин серной кислоты. В Европе для лечения ОА чаще используют глюкозамина сульфат, а в Северной Америке – глюкозамин гидрохлорид. В систематическом Кокрановском обзоре, в котором анализировались наиболее значимые исследования по изучению эффективности и переносимости глюкозамина, дана высокая оценка его симптоматического действия [13]. Эффективность глюкозамина достоверно выше по сравнению с плацебо в плане уменьшения интенсивности болей в суставах, улучшения индекса Лекена, а также увеличения процента больных, ответивших на проводимую терапию. В то же время не получено достоверных результатов при сравнительной оценке эффективности глюкозамина и плацебо по таким параметрам, как скованность и улучшение функциональной способности суставов. Структурно–модифицирующий эффект этого препарата был изучен в двух контролированных исследованиях [14,15]. В первом из них 212 больных с гонартрозом были рандомизированы на 2 группы, которые регулярно принимали глюкозамина сульфат или плацебо в течение 3 лет. Ширина суставной щели увеличилась к концу исследования на 0,12 мм в основной группе, в то время как в группе плацебо она уменьшилась на 0,24 мм. Эти данные свидетельствуют о способности глюкозамина активно воздействовать на темпы прогрессирования ОА. Однако далеко не у всех больных при многолетнем лечении этим препаратом наблюдалось снижение темпов рентгенологического прогрессирования. После трехлетнего непрерывного приема глюкозамина сульфата быстрое прогрессирование заболевания отмечено у 15% больных с сужением суставной щели за этот период более чем на 0,5 мм. Следует также отметить, что терапевтическая активность глюкозамина показана только у больных с гонартрозом, но не коксартрозом. Структурно–модифицирующий его эффект косвенно подтверждается результатами длительного (в среднем 8–летнего) наблюдения за больными, которые лечились глюкозамином в первые 3 года наблюдения. В последующие 5 лет в эндопротезировании коленного сустава нуждалось 10,2% больных основной группы и 14,5% – контрольной, принимающих плацебо. Следует отметить, что глюкозамин, как и другие структурные аналоги хряща, обладает хорошим профилем переносимости и высокой безопасностью. Во всех мета–анализах не было статистических или клинически значимых различий количества и выраженности нежелательных явлений по сравнению с плацебо. На фоне терапии оральным глюкозамином возможны гастроинтестинальные нарушения (тошнота, изжога, диспепсия, абдоминальная боль, склонность к запорам), а также головная боль, учащенное сердцебиение, повышенная утомляемость [16]. Нежелательные явления встречаются редко, они не относятся к категории серьезных и обычно не требуют изменения режима приема препарата или его отмены. Другой структурный аналог хряща – хондроитина сульфат является сульфатированным мукополисахаридом и входит в состав протеогликановых комплексов матрикса хряща. Благодаря наличию карбоксильной и сульфатной групп гликозаминогликаны и, в частности, хондроитин сульфат, обладают выраженной гидрофобностью, а это, в свою очередь, способствует нормальному функционированию хряща и сохранению им эластических свойств. При приеме внутрь он в высоких концентрациях определяется в синовиальной жидкости, при этом его биологическая активность, во многом близка глюкозамину. Уровень доказательности хондроитина сульфата в отношении модификации симптомов ОА столь же высок, как и у глюкозамина сульфат (IA), что нашло свое отражение в рекомендациях EULAR [12]. Он обладает не только противовоспалительной, но и структурно–модифицирующей активностью. Структурно–модифицирующее (хондропротективное) действие препарата связывают с повышением вязкости синовиальной жидкости, повышением синтеза эндогенной гиалуроновой кислоты, а также с влиянием на метаболизм гиалинового хряща, которое проявляется в стимуляции синтеза протеогликанов, ингибиции энзимов деструкции хряща ММР – 3,9,13,14, эластазы, катепсина–β, ингибиции медиаторов воспаления: ИЛ–1, ЦОГ–2, ПГЕ2, NF–kB, снижении апоптоза, концентрации оксида азота и свободных радикалов [11,12]. Leeb B.F. et al. (2000) провели мета–анализ 7 рандомизированных контролированных исследований, в которых участвовало 703 больных ОА с поражением крупных суставов (из них 372 лечились хондроитином сульфатом и 331 принимал плацебо [17]. Длительность терапии составляла от 3 до 12 мес, а доза препарата – от 800 до 2000 мг/сут. Эффективность хондроитина сульфата оказалась достоверно выше по сравнению с плацебо по таким показателям, как боль по ВАШ, индекс Лекена, и по глобальной оценке результатов лечения больным. Переносимость препарата оказалась хорошей и была такой же, как и при приеме плацебо. Из нежелательных явлений чаще отмечались боли в животе (у 18 из 349 больных) и диарея (у 7). Структурно–модифицирующий эффект этого препарата доказан как в экспериментальных, так и в клинических исследованиях. Uebelhart D. et al. (2004) у больных гонартрозом оценивали эффективность и переносимость двух курсов терапии оральным хондроитином по 3 мес на протяжении 1 года в рандомизированном, двойном–слепом, мультицентровом, плацебо–контролированном исследовании [18]. К концу наблюдения альго–функциональный индекс Лекена уменьшился в основной группе на 36% и в контрольной – на 23%. К концу года отмечалось дальнейшее уменьшение суставной щели у больных, которые принимали плацебо, чего не было зафиксировано на фоне терапии хондроитином. В последнем рандомизированном исследовании STOPP Каhan A. и соавт. (2009) оценивали прогрессирование гонартроза при приеме хондроитина сульфата [12]. В исследовании было 622 больных, которые принимали или хондроитина сульфат (основная группа), или плацебо (контрольная группа) в течение двух лет. В основной группе зарегистрировано менее выраженное сужение суставной щели по сравнению с контрольной (–0,07 и 0,31мм, соответственно, р<0,0005) и меньше было больных с рентгенологическим прогрессированием ≥0,25 мм по сравнению с плацебо (28% vs 41%; р<0,0005). Это исследование также показало, что интенсивность боли в суставах лучше контролировалась применением хондроитина, чем плацебо (р<0,001). Не наблюдалось различий в частоте и выраженности нежелательных явлений в основной и контрольной группах. Интересно, что в настоящее время обсуждается влияние малых фрагментов хондроитина сульфата на прогрессирование болезни Альцгеймера, развитие атеросклероза аорты и высыпания плантарного псориаза [11]. Помимо глюкозамина и хондроитина, которые применяются в режиме монотерапии, для лечения остеоартроза разработаны комбинированные препараты, в cостав которых входят эти две субстанции. Комбинированные препараты имеют некоторые преимущества по сравнению с монотерапией. Так, в эксперименте они способствовали увеличению синтеза глюкозаминогликанов хондроцитами на 96,6%, а на фоне монотерапии симптом–модифицирующими средствами замедленного действия – только на 32%; при этом отмечено менее тяжелое поражение по сравнению с применением только глюкозамина или только хондроитина [19]. Следует иметь в виду, что структурные аналоги хряща имеют не только общие, но и отличительные механизмы своего влияния на боль и воспаление при ОА, что способствует нарастанию положительных свойств при их совместном применении. В то же время они являются синергистами и при комбинированном применении дополняют и усиливают действие друг друга. К таким препаратам относится Терафлекс. В 16–недельном рандомизированном контролированном исследовании комбинации глюкозамина гидрохлорида и хондроитина сульфата у больных с остеоартрозом коленных суставов и болью в нижней части спины был отмечен более выраженный терапевтический эффект на общую оценку болезни врачом и пациентом по сравнению с плацебо [20]. Более значимые результаты терапии наблюдались при остеоартрозе по сравнению с межпозвонковым остеохондрозом. По данным Richy F. и соавт., использование комбинации орального глюкозамина и хондроитин сульфата приводит не только к симпптом–модифицирующему, но и структурно–модифцирующему действию, что подтверждается положительной динамикой индекса WOMAC, величиной суставной щели и нормализацией функциональной способности [21]. Авторы подчеркивают хорошую переносимость и высокую безопасность такой комбинации, а также длительную ее эффективность после курса терапии сочетанным применением глюкозамина и хондроитина. Одним из комбинированных симптом–модифицирующих препаратов замедленного действия является Терафлекс [Bayer, Германия]. Каждая капсула Терафлекса включает 500 мг глюкозамина гидрохлорида и 400 мг хондроитина сульфата. Он назначается по 2 капсулы 2 раза в сутки на протяжении первых 3– 4 нед, а затем по 2 капсулы в сутки. Больным с большой массой тела его следует принимать по 2 таблетки 2 раза в сутки. Длительность одного курса составляет не менее 6 мес. Препарат следует принимать повторными курсами. Терапевтическая активность Терафлекса доказана в нескольких клинических исследованиях. В открытом исследовании, проведенном в Институте ревматологии РАМН, изучалась эффективность, переносимость и безопасность Терафлекса у 50 больных с гон– и коксартрозом [22]. Все больные имели клинически выраженный остеоартроз с болевым синдромом, утренней ригидностью и функциональной недостаточностью опорно–двигательного аппарата. Длительность наблюдения составила 6 мес, причем в первые 4 мес больные принимали по 2 капсулы Терафлекса вместе с 1200 мг ибупрофена. При получении положительного эффекта снижали суточную дозу ибупрофена вплоть до полной его отмены. К концу 4 мес непрерывной терапии Терафлекс привел к достоверному снижению суммарного индекса WOMAC, при этом наблюдалась существенная положительная динамика интенсивности боли в суставах, утренней скованности и функциональной недостаточности пораженных суставов. У 26 из 50 больных удалось снизить суточную потребность в ибупрофене. По оценке больных, улучшение к концу 2–го мес терапии наблюдалось в 77,8% случаев и к концу четвертого – в 74,4%, а по оценке врача – в 88,6 и 83,7% соответственно. В последующие 2 мес после прекращения лечения продолжала сохраняться терапевтическая эффективность Терафлекса. В этом исследовании была продемонстрирована хорошая переносимость препарата. Нежелательные явления наблюдались лишь у 6 больных и были связаны в основном с приемом ибупрофена. Терафлекс в единичных случаях вызывал появление болей в верхней половине живота и задержку стула. В другом открытом рандомизированном многоцентровом испытании (6–мес) также проводилась оценка эффективности Терафлекса при лечении больных с клинически выраженным остеоартрозом коленного сустава и деформирующим спондилезом [23]. У всех больных боль при ходьбе по шкале ВАШ была выше 40 мм, а рентгенологическая стадия соответствовала I–III стадиям по Kellgren и Lawrence. Больные первой (основной) группы принимали Терафлекс с диклофенаком и второй (контрольной) – только диклофенак. К концу 3 мес в основной группе достоверно уменьшилась интенсивность боли в суставах, которая оставалась на этом уровне до конца 6 мес лечения. Во второй группе также наблюдалась положительная динамика этого показателя, хотя и в меньшей степени по сравнению с основной группой. Аналогичное улучшение отмечено и по функциональному индексу WOMAC. К концу 6 мес лечения в первой группе по оценке врача зарегистрировано значительное улучшение у 23,3% больных и улучшение – у 60%, а в контрольной – у 16,7 и 40% соответственно. В то же время неэффективность проводимой терапии зарегистрирована у 23% больных контрольной группы и только у 3,3% – основной. Как и в предыдущем исследовании, наблюдалась хорошая переносимость Терафлекса. Всего в группе Терафлекса выявлено 5 нежелательных явлений, в контрольной – 8. На фоне приема Терафлекса наблюдались изжога, боли в верхней половине живота, метеоризм, которые были слабо выраженными и не потребовали отмены лечения этим препаратом. В одном случае наблюдалась аллергическая реакция, потребовавшая отмены препарата. Таким образом, Терафлекс обладает отчетливым симптом–модифицирующим действием у больных ОА, которое проявляется снижением интенсивности боли и улучшением функции пораженных суставов. Он также позволяет снизить суточную потребность в НПВП. Что же касается доказательства его структурно–модифицирующих свойств, то для этого необходимо проведение длительного лечения этим препаратом (на протяжении ряда мес или даже лет) с тщательным анализом ширины суставной щели по данным рентгенологического и МРТ исследований, а также определения объема суставного хряща до и после проведения такой терапии. В настоящее время вопрос о непосредственно хондропротективном действии структурных аналогов хряща решается неоднозначно. Все больше исследователей придерживаются точки зрения, что так называемые хондропротективные препараты не столько стимулируют синтез матрикса хряща, т.е. продукцию протеогликанов, гликозаминогликанов и гиалуроновой кислоты при ОА, сколько обладают антивоспалительным действием, которое реализуется при длительном их назначении. Позитивное решение данной проблемы во многом затруднено отсутствием высокоинформативных методов, которые позволяют адекватно судить о метаболизме хрящевой ткани. С другой стороны, далеко не всегда удается провести соответствующие исследования, которые удовлетворяли бы критериям прогрессирования ОА. Однако не вызывает сомнений, что симптом–модифицирующие препараты замедленного действия активно уменьшают выраженность основных субъективных проявлений этого заболевания, способствуют разрешению синовита, позитивно влияют на персистенцию воспалительного процесса в тканях сустава, а также обладают хондропротективным эффектом, который выражается главным образом в замедлении рентгенологического прогрессирования заболевания.
|
Powered by Disqus
|